- 与美国国立卫生研究院(NIH)过敏和传染病研究所(NIAID)合作开展研究性单克隆抗体BRII-196和BRII-198联合用药的临床研究,用于治疗新冠肺炎(COVID-19)
- 持续快速推进在研新药的开发工作,以对抗乙型肝炎(HBV)、多重耐药革兰氏阴性菌感染以及艾滋病(HIV)等传染病的严重威胁
- 高效推进中枢神经系统疾病项目,计划于2021年1月提交BRII-296的新药临床试验申请
- 美国领导团队进行人事任命并进一步壮大
北京与北卡罗来纳州达勒姆市2020年12月18日 /美通社/ -- 美国东部时间2020年12月17日,腾盛博药(Brii Biosciences),一家横跨中美,致力于开发创新药物以服务患者需求,并提升全球和中国公共卫生水平的生物技术公司,今天发布了公司最新研发动态。公司的6种治疗候选药物在研发方面取得了重大进展,这些药物用于应对世界上极其严重的传染病威胁,包括新冠肺炎、乙型肝炎和多重耐药革兰氏阴性菌感染等。
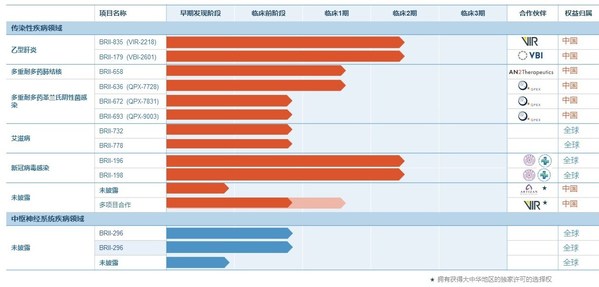
腾盛博药项目进展
“ 腾盛博药致力于解决当今社会面临的最紧迫的公共卫生难题,通过加快新药开发来预防、治疗和治愈一系列传染病,包括新冠肺炎、慢性乙型肝炎、多重耐药革兰氏阴性菌感染以及艾滋病等,”腾盛博药首席执行官洪志博士说。“世界急需治疗新冠肺炎的新药,但对于传染病新药的需求远远超出当今的新冠肺炎疫情。传染病可导致死亡和残疾,并对社会和经济带来破坏性的影响,这是我们不能忽视的事实。我们必须为今后不可避免的公共卫生挑战做好准备。腾盛博药积极应对这一挑战,致力于改善人们的健康状况和生活质量,无论他们身在何处。”
SARS-CoV-2项目进展
- BRII-196和BRII-198为非竞争性新型冠状病毒(SARS-CoV-2)中和抗体,其中特别应用了基因工程技术以降低抗体依赖性增强作用的风险。新型冠状病毒(SARS-CoV-2) 感染导致新冠肺炎(COVID-19)。腾盛博药正在与美国国立卫生研究院(NIH)下属的国家过敏和传染病研究所(NIAID)合作,进行抗体联合用药疗法的二/三期临床研究。这项研究属于NIAID的 ACTIV-3主临床方案的一部分,将检验在标准治疗基础上,BRII-196和BRII-198联合疗法在患有更严重疾病的住院病人中的临床安全性和有效性。该研究(NCT04501978)于2020年12月开始给药,初步结果有望在明年年初获得。一旦获得有效的临床数据,腾盛博药将与世界各国的监管机构紧密合作,确保将数据尽快提交进行审查,以便让可能从该疗法中受益的患者第一时间得到治疗。同时,为BRII-196和BRII-198疗法在高危非住院患者中进行研究的准备工作也进展到了最终阶段。
- 腾盛博药还于2020年11月向香港特别行政区政府卫生署提交了针对BRII-196和BRII-198联合用药的新药临床试验申请,并于2020年12月向美国食品药品管理局提交了针对该研究的新药临床试验申请。该临床试验将研究该疗法在患有新冠肺炎的亚洲人群中的临床安全性和有效性,预计将于2021年初启动。
乙型肝炎(HBV)治愈项目进展
- 1b/2a期临床试验的中期数据旨在评估BRII-179(VBI-2601)(一种新型重组蛋白免疫疗法)的安全性、耐受性和抗病毒活性,已证明其诱导慢性乙肝患者中产生抗体和T细胞反应。
- 公司宣布已完成BRII-835(VIR-2218)2期临床试验的招募工作,这是一种新型的在研RNA干扰治疗药物(RNAi),旨在抑制包括乙肝表面抗原(HBsAg)的表达在内的所有乙肝病毒蛋白的表达。中期数据预计将于2021年第二季度公布。
- 在2021年第一季度,公司还准备启动一项二期临床试验,以证明BRII-179和BRII-835联合用药在持续接受核苷酸治疗的患者中的安全性和有效性。
多药耐药革兰氏阴性细菌感染项目进展
腾盛博药将与Qpex Biopharma公司合作,在中国开发和商业化一系列新型抗生素产品,以治疗由高度耐药的革兰氏阴性病原体引起的感染。
- 一种全新超广谱β-内酰胺酶抑制剂BRII-636(QPX-7728)的一期临床试验于2020年11月在美国获得新药临床试验批准并启动。这项一期试验将研究在健康成人受试者中首先单独使用BRII-636进行单次和多次静脉注射,进而与β-内酰胺类抗生素联合使用的安全性和药代动力学。
- 即将在美国提交BRII-672的新药临床试验申请,该药物为一种口服超广谱β-内酰胺酶抑制剂,用于治疗产生超广谱β-内酰胺酶(ESBL)和碳青霉烯酶的肠杆菌,一期临床研究将于2021年3月启动。
- 将在美国提交BRII-693(QPX-9003)的新药临床试验申请,该药物为新一代合成多粘菌素,用于治疗由铜绿假单胞菌和鲍氏不动杆菌引起的多药耐药性感染,预计于2021年3月启动一期临床研究。
艾滋病(HIV)项目进展
- 公司在为艾滋病毒感染者开发一种全新的治疗方案,每周口服一片药,并计划于2021年1月在美国提交BRII-778新药临床试验申请,该药物有望实现每周只需口服一次。
- 公司开发的另一种有望实现每周口服一次的分子药物BRII-732也计划于2021年1月在美国提交新药临床试验申请。
- BRII-778和BRII-732的一期临床试验均预计于2021年2月启动。
中枢神经系统疾病(CNS)项目进展
- 公司将继续推进中枢神经系统疾病的项目,重点改善对患有严重中枢神经系统疾病而没有有效疗法患者的治疗。公司计划于2021年1月提交BRII-296的美国新药临床试验申请,并预计于2021年3月启动一期临床试验。
管理层行政任命
腾盛博药同时宣布了几项管理层人事任命,以助力公司在美国的持续增长。
- David Margolis博士加入腾盛博药担任副总裁,负责公司在美国的传染病临床项目。Margolis博士也将支持中国的临床项目并提供战略建议。加入腾盛博药之前Margolis博士就职于GSK和ViiV Healthcare公司。
- 钟礼杰博士从美国吉利德公司加入腾盛博药担任副总裁,负责生物统计、流行病学及真实世界研究(RWE)。他将带领各方团队采用确实有效的方法设计临床试验,收集、分析和解读临床试验数据,以实现新药的批准和上市。
- Lorraine Horgan女士晋升为副总裁,负责项目规划与管理。Horgan女士于2019年8月加入腾盛博药,负责建立项目管理部门。她对于传染病等多个治疗领域和多种治疗方法都有丰富的经验,并具备全面和系统的药品开发经验。
- 马骥博士晋升为副总裁,负责临床前研究和开发。马博士于2019年6月加入腾盛博药,建立了公司的药代动力学和临床药理学部门,并协助将所有项目从临床前阶段推进到临床阶段。他对多种治疗方法拥有20多年的药物发现和开发经验。


